O que é cinética química?
A cinética química é o ramo da ciência responsável por estudar a velocidade das reações químicas e os fatores responsáveis por alterá-la.
De modo geral, rapidez ou velocidade de uma reação é a grandeza que indica como as quantidades de reagente(s) e produto(s) dessa reação variam com o passar do tempo.
Sendo assim, utiliza-se uma expressão para definir essa grandeza:
vm = l Δ quantidade l / Δ tempo
Nessa equação, l Δ quantidade l indica o módulo de variação da quantidade de um reagente ou produto, isto é, l quantidade final – quantidade inicial l que pode ser expressa em massa, mols, concentração ou em volume.
Para compreender como a cinética é estudada, considere uma reação genérica:
aA + bB → cC + dD
em que A e B correspondem aos reagentes da reação, C e D aos produtos formados, enquanto a, b, c e d são os coeficientes estequiométricos da equação balanceada.
O que acontece é que enquanto os reagentes vão sendo consumidos, os produtos começam a ser formados. Essa variação na concentração, em um mesmo intervalo de tempo, obedece à proporção dos coeficientes.
Considere, então, uma experiência em que se coloca em um recipiente fechado a amônia gasosa (NH3) em uma concentração inicial de 10,0 mol L-1.
Com a passagem do tempo, ocorre a reação mostrada a seguir:
2 NH3(g) → N2(g) + 3H2(g)
Com a utilização de métodos específicos é possível acompanhar como a concentração da amônia varia.
| [NH3] (mol/L) | 10,0 | 5,0 | 2,5 |
| Tempo (h) | 0 | 1 | 2 |
Com a equação da velocidade média, calcula-se a velocidade de consumo do NH3 durante a reação:
- entre 0h e 1h:
vm = l 5 -10 l / 1= 5 mol L-1 h-1
- entre 1h e 2h:
vm = l 2,5 -5 l / 1= 2,5 mol L-1 h-1
A partir desses resultados, tem-se que a velocidade da reação nem sempre é constante.
Teoria das colisões na cinética química
A teoria das colisões é utilizada para determinar a ocorrência das reações. Segundo essa teoria, em reações gasosas, os reagentes devem estar em contato por meio de colisões. No entanto, nem toda colisão é eficaz e forma o produto desejado.

Para que uma colisão seja eficaz, é necessário que aconteça com geometria favorável e com uma energia suficiente, uma vez que, no momento da colisão, há uma ruptura parcial das ligações químicas das moléculas dos reagentes e essa ruptura provém do movimento das moléculas.
Essa energia suficiente corresponde a energia de ativação.
Energia de ativação
A energia de ativação (Ea) é o valor mínimo de energia que as moléculas de reagentes devem possuir para que uma colisão entre elas seja eficaz. Desse modo, quanto maior essa energia, mais lenta é a reação.
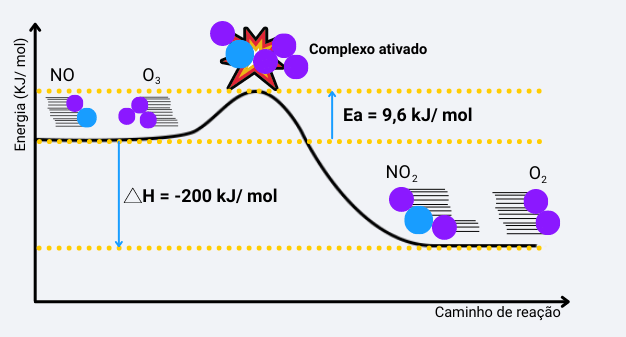
O que ocorre é que essa energia favorece a formação de um complexo ativado que é um estado de transição até que os produtos sejam, de fato, formados.
Fatores que influenciam a cinética química
Os principais fatores responsáveis por alterar a velocidade das reações são: concentração dos reagentes, temperatura, superfície de contato, pressão e catalisadores.
Concentração de reagentes
O aumento da concentração dos reagentes provoca um aumento no número de colisões entre as moléculas, o que acelera a reação. Desse modo, o aumento da concentração também aumenta a velocidade da reação.
Temperatura
Como a temperatura corresponde ao grau de agitação das moléculas, sendo uma medida da energia cinética. Sendo assim, o aumento da energia proporciona um aumento da agitação das partículas e logo, aumenta a velocidade da reação. Assim, o aumento da temperatura, aumenta também a velocidade da reação.
Superfície de contato
A superfície de contato interfere na velocidade de reação dos reagentes sólidos. É importante compreender que a superfície de contato é a área que fica disponível para interação com as outras moléculas dos reagentes. Desse modo, o aumento da superfície de contato influencia no aumento da velocidade de reação.
Pressão
Com o aumento da pressão, considerando substâncias gasosas, ocorre a diminuição do espaço existente entre as moléculas e assim, promove-se o aumento das colisões. Logo, o aumento da pressão aumenta a velocidade da reação.
Catalisadores
Os catalisadores são utilizados para promover a diminuição da energia de ativação de uma reação, acelerando uma reação sem serem consumidos. Ou seja, a presença de um catalisador aumenta a velocidade da reação.
Lei cinética
Para uma reação genérica cuja equação é:
aX + bY → produtos
É possível calcular a velocidade de reação por meio da concentração de reagentes determinando, então, a lei de velocidade ou lei cinética da reação, utilizando a seguinte expressão:
v = k . [X]m. [Y]n
em que: v é a velocidade da reação; k é a constante de velocidade (é uma constante de proporcionalidade, característica da reação e da temperatura); [X] e [Y] a concentração dos reagentes em mol/L e m e n expoentes determinados experimentalmente e conhecidos como ordem de reação.
O termo m corresponde a ordem de reação em relação a X, enquanto o termo n é a ordem de reação em relação a Y. A soma dos dois termos é a ordem global da reação.
Exemplo
Considere a reação de decomposição do N2O5:
N2O5(g) → 4NO2(g) + O2(g)
A reação foi realizada 3 vezes, mudando-se a concentração inicial do reagente e mantendo as demais condições inalteradas, como a temperatura. A cada nova repetição, verificou-se a velocidade inicial da reação que são apresentados pela tabela a seguir:
| [N2O5] mol/ L | Velocidade inicial da reação ( mol/ L.h) |
| 0,010 | 0,016 |
| 0,020 | 0,032 |
| 0,030 | 0,048 |
Desse modo, analisando os valores apresentados observamos que da 1a para a 2a linha a concentração de N2O5 duplica e assim, a velocidade da reação também duplica. Quando a concentração do reagente triplica (1a para a 3a linha) a velocidade inicial também triplica.
Ou seja, pode-se concluir que a velocidade da reação é diretamente proporcional à concentração do reagente e assim:
v = k . [N2O5]
Portanto, a velocidade da reação em temperatura constante é proporcional a variação da concentração do reagente. Caso ao duplicar a concentração, a velocidade observada se multiplicasse por 4, a ordem de reação seria 2, uma vez que, a velocidade aumenta em 4 (= 22). Se triplicar a concentração e a velocidade ficar multiplicada por 9, há a comprovação de que a ordem de reação é 2 já que 9 = 32.









