O que é a energia livre de Gibbs?
A energia livre de Gibbs (ΔG) é uma grandeza termodinâmica elaborada por Josiah Willard Gibbs em 1883 para prever a espontaneidade de uma reação.
Sabe-se que existem reações espontâneas e não espontâneas. Um exemplo disso é a reação de combustão que ocorre espontaneamente depois que o processo se inicia e continua até o fim do combustível disponível ou então até o momento que o oxigênio acaba. Mas não são todas as reações que são espontâneas. O processo de cozimento dos alimentos, por exemplo, é um processo não espontâneo, uma vez que precisa de uma fonte de calor para ocorrer.
Até o ano de 1883, acreditava-se que a espontaneidade de uma reação era determinada por duas grandezas: a variação de entalpia (ΔH) e a variação de entropia (ΔS). Desse modo, as reações aconteceriam naturalmente se: ΔH<0 (reação exotérmica em que há a liberação de energia) e ΔS>0 (em que o sistema está desorganizado).
No entanto, os estudos realizados por Gibbs permitiram que ele observasse que durante o acontecimento de uma reação espontânea (reação exotérmica), parte da energia liberada acabava sendo utilizada para promover a reorganização do sistema. Essa reorganização era dependente da temperatura e do grau de desorganização dos átomos envolvidos na reação (ΔS).
Desse modo, a energia livre de Gibbs é a energia útil do sistema utilizada para realizar trabalho. Essa energia útil é resultante da diferença entre a entalpia e a entropia multiplicada pela temperatura, uma vez que, a previsão da espontaneidade de uma reação é dependente desses fatores: entalpia, entropia e temperatura.
Como determinar a energia livre de Gibbs?
Para calcular o valor dessa energia, Gibbs criou uma fórmula juntamente com o físico Hermann Helmholtz, que relaciona os aspectos mencionados anteriormente, sendo mostrada a seguir:
ΔG = ΔH – TΔS
A energia livre de Gibbs pode apresentar unidade de grandeza: Joule (J), Quilojoule (KJ), caloria (cal) e quilocaloria (Kcal).
Importante ressaltar que:
ΔG → corresponde a variação energia livre de Gibbs;
ΔH → variação da entalpia;
T → é a temperatura do sistema;
ΔS → variação da entropia.
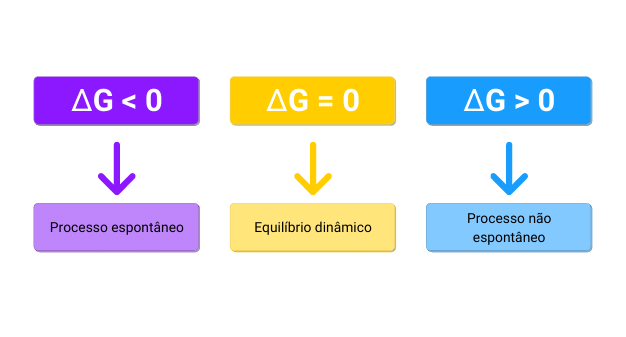
Ao utilizar a equação apresentada, pode-se encontrar resultados positivos ou negativos. Quando o resultado observado for negativo, a reação é considerada espontânea. No entanto, se o resultado calculado for positivo, o processo não será espontâneo.
Conclusões a respeito da fórmula da energia livre de Gibbs
- A utilização da expressão apresentada só ocorre em condições em que a pressão e a temperatura são mantidas constantes;
- Para aplicação na fórmula, a temperatura tem que estar em kelvin;
- A energia livre de Gibbs é a fração de energia que realizará o trabalho. Essa energia corresponde ao valor máximo de energia que pode ser retirado do sistema;
- As unidades de medida de ΔH e ΔS no cálculo da energia livre devem ser iguais.
Condições para espontaneidade das reações
Para prever a espontaneidade de uma reação, então, há algumas condições experimentais em relação a entalpia, entropia e temperatura do sistema. Lembrando que, como a energia livre de Gibbs é a energia utilizada em uma reação espontânea para reorganizar o sistema, sendo uma energia liberada, ΔG<0.
ΔH>0 e ΔS<0
Considerando a equação:
ΔG = ΔH – TΔS
Temos que:
ΔG = +ΔH – T(-ΔS)
Desse modo, encontramos um valor de ΔG>0 e portanto, nessas condições, a reação não será espontânea.
ΔH>0 e ΔS>0
Considerando a equação:
ΔG = ΔH – TΔS
Temos que:
ΔG = +ΔH – T(+ΔS)
Nesse caso, a espontaneidade da reação é dependente do valor da temperatura do sistema. Se o valor obtida na multiplicação de T x ΔS for maior do que o valor ΔH, a reação será espontânea. Caso contrário, a reação é não espontânea.
ΔH<0 e ΔS>0
Considerando a equação:
ΔG = ΔH – TΔS
Temos que:
ΔG = -ΔH – T(+ΔS)
Nessas condições, o valor de ΔG<0 e por isso, a reação será espontânea.
ΔH<0 e ΔS<0
Considerando a equação:
ΔG = ΔH – TΔS
Temos que:
ΔG = -ΔH – T(-ΔS)
Aqui, nessas condições, a espontaneidade também dependerá da grandeza da temperatura. Se o resultado da multiplicação da temperatura pela entropia for menor que o valor da entalpia, o processo será espontâneo.
Podemos resumir então:










