Prova 1 – Cursos das áreas de biológicas
A solução aquosa de anilina é básica devido à ocorrência do equilíbrio:
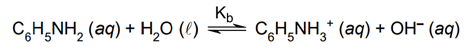
Sabe-se que Kb ≈ 4 × 10–10 a 25 ºC e que o valor de pH de uma solução aquosa saturada de anilina a 25 ºC é próximo de 9. Com base nessas informações e sabendo que Kw nessa temperatura é igual a 1 × 10–14, a concentração aproximada da solução saturada de anilina a 25 ºC é
(a) 0,02 mol/L.
(b) 0,5 mol/L.
(c) 0,1 mol/L.
(d) 0,3 mol/ L.
(e) 0,8 mol/L.
Resolução
A partir do equilíbrio fornecido, tem-se que:
pH = [H+] = 1 x 10-9 mol/L
pOH = [OH–] = 1 x 10-5 mol/L
Desse modo, analisando-se a reação temos que a concentração da espécie C6H5NH3+ é também de 1 x 10-5 mol/L.
Para o cálculo da anilina, então:
Kb = [C6H5NH3+ ] . [OH-]/ ([C6H5NH2])
4 x 10-10 = (1 x 10-5 x 1 x 10-5)/ [C6H5NH2]
[C6H5NH2] = 0,25 mol/L
Sendo assim, a resposta que mais se aproxima é 0,3 mol/L.
Resposta: D







