O que é a pilha de Daniell?
A pilha de Daniell é constituída por dois eletrodos: um ânodo e um cátodo. No ânodo, o zinco perde elétrons por meio de uma reação de oxidação, enquanto, no cátodo, o cobre recebe esses elétrons por meio de um processo de redução.
A origem dessa pilha é datada em 1836. Neste ano, John Frederic Daniell (1790-1845) construiu uma pilha que era formada por dois eletrodos separados em duas semicelas.
Em um dos eletrodos, havia uma placa de zinco metálico mergulhada em uma solução aquosa que continha cátions Zn2+ presentes em uma solução de sulfato de zinco, ZnSO4. Já o outro eletrodo era formado por uma placa de cobre metálico colocada em uma solução aquosa de sulfato de cobre, CuSO4, que apresentava os íons Cu2+.
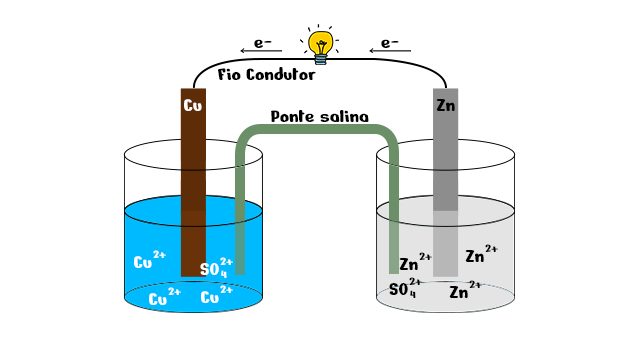
Desse modo, os eletrodos eram formados por um metal imerso em uma solução de sal que possuía cátions desse metal.
Ambos os eletrodos eram interligados por meio de um circuito externo, geralmente formado por um fio metálico ligado a ambas as placas, uma lâmpada em contato com o fio metálico e uma ponte salina em contato com as soluções aquosas dos eletrodos.
Uma observação realizada por Daniell é a de que a lâmpada conectada ao sistema, durante o experimento, acende. Ou seja, o conjunto de eletrodos, fios metálicos e ponte salina favoreceu uma movimentação ordenada de cargas elétricas que originaram uma corrente elétrica. Outro fato relacionado à lâmpada acesa é que há uma diferença de potencial elétrico entre as placas metálicas de cobre e zinco.
Como funciona a pilha de Daniell?
Estudos mais detalhados sobre o funcionamento da pilha de Daniell revelam que, com o passar do tempo, à medida que a lâmpada permanece acesa:
- A concentração de íons cobre (II) diminui na solução de sulfato de cobre (II). Esse fato pôde ser observado devido à mudança de coloração da solução de cobre (II) que inicialmente era azulada mas com o tempo foi perdendo a cor;
- A concentração de íons zinco (II) aumenta na solução aquosa de sulfato de zinco (II);
- A placa de zinco sofre corrosão, uma vez que perdeu massa;
- Enquanto, sobre a placa de cobre depositou-se mais cobre metálico.

Essas observações permitiram chegar à conclusão de que os elétrons fluem, por meio do fio condutor, da placa de zinco (menor potencial) para a de cobre (maior potencial).
Na pilha de Daniell, o zinco é o metal que possui maior reatividade e assim, tende a se oxidar mais facilmente. Ao sofrer o processo de oxidação, o zinco metálico perde elétrons. Logo, a placa de zinco constitui o eletrodo negativo do sistema, sendo o ânodo. A semi-reação que ocorre na placa é mostrada pela reação a seguir:
Zn (s) ↔ Zn2+(aq) + 2e–
Nessa reação, o Zn (s) corresponde a placa metálica, enquanto o Zn2+(aq) vai para a solução e os dois elétrons fluem através do fio metálico. Portanto, como o zinco metálico foi consumido, transformando-se em cátions, a massa da placa foi diminuindo.
Esses elétrons perdidos pela placa metálica de zinco são transferidos por meio do circuito externo para a placa de cobre metálico e depois para a solução de CuSO4. Desse modo, os cátions de Cu2+ presentes na solução recebem esses elétrons e sofrem o processo de redução. Sendo assim, a placa de cobre constitui o eletrodo positivo e é o cátodo do sistema. A reação de redução é mostrada a seguir:
Cu2+(aq) + 2e– ↔ Cu (s)
Já nessa reação, os íons estão presentes na solução aquosa e o Cu (s) deposita-se na placa. Nesse caso, os íons cobre (II) foram consumidos, enquanto o aumento da massa se deve ao acúmulo de cobre metálico na placa.

A equação geral que representa as reações ocorridas nos eletrodos é:
Zn (s) + Cu2+(aq) ↔ Cu (s) + Zn2+(aq)
Qual a diferença entre a pilha de volta e de Daniell?
A pilha de volta é formada por discos intercalados de dois metais diferentes e conectados por um fio condutor. Nesse caso, eram discos de zinco e de prata, além de um disco umedecido com salmoura. Essa montagem intercalada entre os três tipos de discos era realizada até que se alcançasse uma coluna alta e que se sustentasse sozinha, sendo as extremidades conectadas por um fio condutor.
A pilha de volta recebe esse nome devido ao seu criador, Alessandro Giuseppe Anastasio Volta (1745-1827). Essa foi a primeira pilha elétrica que aproveitou a energia das reações de oxidação e redução para geração de eletricidade sendo construída em 1800.
A pilha de Daniell foi um aprimoramento dessa pilha, tornando-a menos arriscada. Diferentemente da pilha de volta, a pilha de Daniell é constituída por duas semicélulas eletroquímicas formada por placas metálicas mergulhadas em soluções aquosas que apresentavam cátions dos metais, em que eram interligadas por um fio condutor.









