O que é afinidade eletrônica?
A afinidade eletrônica (ou eletroafinidade) é uma propriedade periódica que corresponde à quantidade de energia liberada por um átomo, isolado e em estado gasoso, quando recebe um elétron.
X(g) + e– → X–(g) + energia
O que acontece é que esse átomo, encontra-se instável e ao receber esse elétron passa a ser estável.
Essa propriedade é difícil de ser quantizada. Desse modo, muitos elementos não apresentam um valor medido experimentalmente. Em alguns casos, inclusive, esse valor é teórico ou foi calculado em função do número atômico.
Além disso, não se aplica à família dos gases nobres. Esse fato se deve à estabilidade desses átomos por possuírem orbitais completos na camada de valência.
Afinidade eletrônica na tabela periódica
A afinidade eletrônica varia de acordo com três conceitos: raio atômico, período e família.
De modo geral, a variação ocorre no sentido horizontal, da esquerda para direita e no sentido vertical de baixo para cima.
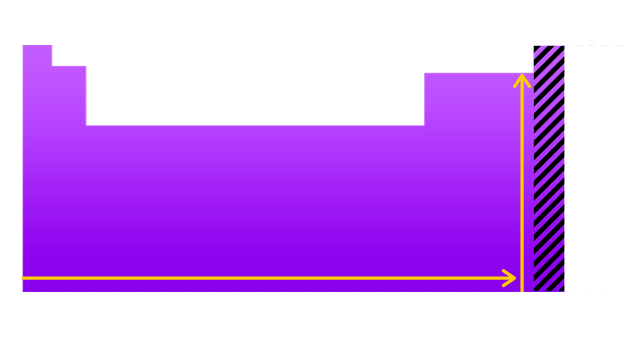
Assim, os elementos que possuem maior valor dessa propriedade são os halogênios e o oxigênio.
Raio atômico
Em relação ao raio atômico, a afinidade eletrônica é inversa. Ou seja, conforme o raio atômico aumenta, o valor da eletroafinidade diminui e vice-versa.
Isso acontece devido à força de atração do núcleo ser maior do que os elétrons presentes nas últimas camadas eletrônicas.
Período
Analisando um mesmo período da tabela periódica, tem-se que quanto maior o número atômico, maior a afinidade eletrônica. O que acontece é que com o maior número atômico, maior será o número de prótons no núcleo e assim, maior será a força de atração nuclear em relação aos elétrons mais distantes. Desse modo, em um mesmo período, a eletroafinidade varia aumentando da esquerda para a direita.
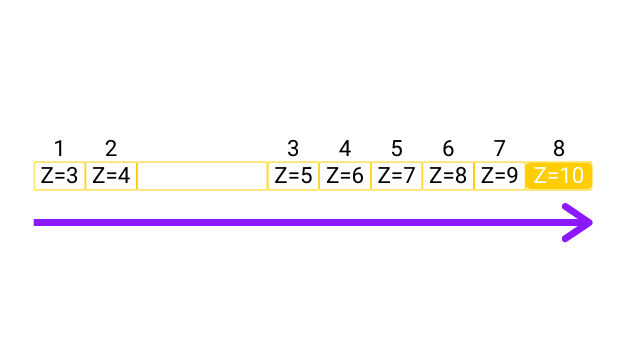
Se compararmos essa propriedade do flúor presente na família 17 com o lítio localizado na família 1, veremos essa diferença. O flúor possui energia de 328 kJ, enquanto o lítio tem eletroafinidade no valor de 60 kJ. Entre esses dois átomos, o que ocorre é que o flúor apresenta uma maior capacidade de atrair os elétrons.
Família
No caso de uma família da tabela periódica, quanto menor for o número atômico e o número de níveis de energia, maior será a afinidade eletrônica. Nesse caso, em uma mesma família, o menor número atômico torna a força de atração do núcleo maior em relação aos elétrons localizados na periferia do átomo. Sendo assim, numa família, a eletroafinidade cresce de baixo para cima.

Ao analisarmos o lítio e o potássio que são pertencentes à mesma família, verifica-se que os valores de energia liberada são de 60 kJ e 48 kJ, respectivamente.
Qual é a diferença entre eletronegatividade e afinidade eletrônica?
Embora as duas propriedades sejam propriedades periódicas, ou seja, que variam de acordo com o número atômico, elas não representam a mesma coisa. Com exceção da família dos gases nobres, ambas aumentam no sentido da esquerda para a direita e de baixo para cima na tabela periódica.
Sendo assim, a diferença está no que cada uma dessas propriedades implica. A eletronegatividade está relacionada com a atração dos átomos pelos elétrons, enquanto a afinidade eletrônica possui relação com a energia liberada no momento em que um átomo recebe um elétron.








