O que é átomo
O átomo é a partícula fundamental da matéria, sendo formado por prótons, elétrons e nêutrons. Essa unidade é a fração responsável pela identificação de um elemento químico sendo a base para a formação da matéria.
A palavra átomo vem do grego e significa indivisível, no entanto, atualmente sabe-se que há outras subunidades que formam o átomo.
História do átomo
A história do átomo se inicia nas investigações conduzidas pelos antigos gregos na busca de um elemento primordial que seria a origem de toda a matéria visível.
Para Tales de Mileto (624-546 a.C), o elemento formador e o começo de todas as coisas era a água. Por sua vez, Empédocles (490-430 a.C), considerava os quatro elementos fundamentais constituintes da matéria como sendo: a água, o fogo, a terra e o ar. Assim como ele, Aristóteles (384-322 a.C) também creditava aos quatro elementos fundamentais a origem da matéria.
O conceito de átomo só foi utilizado pela primeira vez por Demócrito (470-380 a.C) e Leucipo (460-370 a.C) que consideravam que toda a matéria presente no universo era formada por partículas tão pequenas que não poderiam mais ser divididas. Para eles, havia apenas um tipo específico de átomo que era eterno e que se movia no vazio. Além de propor a existência do átomo, Demócrito e Leucipo também atribuíram-lhe propriedades e características que explicassem o comportamento macroscópico da matéria.
Somente em 1803, que John Dalton fundamentou o primeiro modelo atômico para explicar a estrutura da matéria, sendo considerado o pai da teoria atômica moderna.
Modelos atômicos
Até se estabelecer a estrutura atômica que se conhece hoje, muitos modelos atômicos foram propostos por diferentes cientistas ao longo dos anos.
Modelo atômico de Dalton
O modelo atômico de Dalton foi proposto entre 1803-1807 e é conhecido como modelo da “bola de bilhar”. Para ele, o átomo é a menor unidade formadora da matéria, sendo maciça, esférica, indivisível e indestrutível.
Modelo atômico de Thomson
Em 1897, Thomson propôs que o átomo fosse formado por uma esfera com partículas de carga positiva revestidas por outras partículas que apresentavam carga negativa, os elétrons. Esse modelo passou a ser conhecido como “pudim de passas”.
Essa estruturação ocorreu após a conclusão obtida por Thomson em um experimento utilizando tubos de raios catódicos em que constatou a existência de partículas que eram menores que um átomo e possuíam carga elétrica negativa.
Modelo atômico de Rutherford
Em 1911, Rutherford realizou experimentos bombardeando finíssimas folhas de ouro com partículas alfa. Com esse experimento, Rutherford concluiu que a maior parte da massa do átomo encontrava-se no centro (núcleo) em que era positivamente carregado e representava uma pequena fração do volume atômico total, uma vez que o núcleo era rodeado por partículas de carga negativa (elétrons). No entanto, o modelo não conseguiu esclarecer como essas cargas negativas estavam distribuídas.
Essa conclusão só foi possível diante da observação de que algumas partículas alfa atravessavam as folhas de ouro, enquanto outras eram totalmente refletidas ou desviadas.
Modelo atômico de Rutherford-Bohr
Niels Bohr foi responsável por aprimorar o modelo atômico de Rutherford sendo responsável por propor um modelo planetário. Nesse modelo, os elétrons se movimentavam ao redor do núcleo em órbitas circulares e fixas.
Para Bohr, a eletrosfera de um átomo é formada por camadas de energia em que a camada mais externa possui uma maior energia. Além disso, o elétron poderia saltar de um nível para outro ao receber ou perder energia. Ao receber energia, ele é capaz de saltar para uma camada mais externa retornando a camada original assim que liberar energia em forma de luz.
Estrutura atômica
A estrutura atômica representa a constituição de um átomo que é formado por partículas subatômicas: prótons, nêutrons e elétrons. Sendo assim, o átomo apresenta um núcleo que concentra a maior parte da massa e onde se encontram os prótons e os nêutrons em que é rodeado por uma nuvem de elétrons conhecida como eletrosfera.
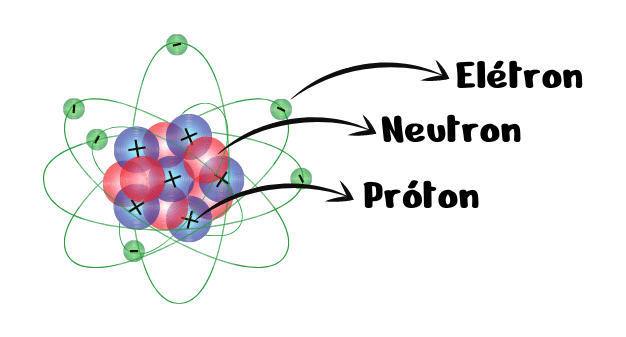
Prótons
Os prótons são partículas que apresentam carga elétrica positiva e que constituem o núcleo dos átomos juntamente com os nêutrons. São formados por partículas fundamentais conhecidas como quarks e possuem massa unitária.
Nêutrons
Os nêutrons estão presentes no núcleo dos átomos, mas diferentemente dos prótons não possuem carga positiva e sim neutra. A neutralidade de carga elétrica proporciona uma estabilidade ao núcleo atômico, diminuindo a repulsão entre prótons e elétrons.
Elétrons
Os elétrons são partículas que apresentam carga elétrica negativa que estão dispostas ao redor do núcleo formando uma nuvem eletrônica conhecida como eletrosfera, mantendo-se conectados devido a uma força eletromagnética. A eletrosfera apresenta níveis e subníveis de energia.
Níveis de energia
Os níveis de energia ou camadas eletrônicas são os locais ocupados pelos elétrons na eletrosfera. As camadas são nomeadas em: K, L, M, N, O, P e Q ou 1, 2, 3, 4, 5, 6 e 7. Cada camada pode receber um número máximo de elétrons e conforme se afasta do núcleo mais energizado os elétrons se tornam.
Subníveis de energia
Em cada camada eletrônica, os elétrons estão distribuídos em subníveis de energia ou subcamadas que são representadas pelas letras: s, p, d, f. Essas subcamadas apresentam ordem crescente de energia e estão presentes em todos os níveis. No entanto, o número de subníveis existentes em cada camada depende do número máximo de elétrons que ela pode receber.
Representação atômica
A representação atômica corresponde à sigla do conjunto de átomos que formam um elemento químico. Juntamente com a sigla, encontra-se o número atômico e o número de massa do elemento.
Número atômico
O número atômico relaciona-se ao número de prótons presente no núcleo do átomo, correspondendo também ao número de elétrons presentes na eletrosfera. Representado pela letra Z e encontrado no canto inferior esquerdo da sigla do elemento.
ZX
Número de massa
Como o nome diz, o número de massa corresponde a massa do átomo que resulta da soma entre prótons e nêutrons encontrados no núcleo, representado pela letra A sendo encontrado no canto superior da sigla do átomo.
ZAX ou ZXA
Semelhanças atômicas
Os átomos podem ser agrupados de acordo com algumas semelhanças existentes entre eles levando em consideração: número de prótons, elétrons, nêutrons e massa.
Isótopos
São átomos que apresentam o mesmo número atômico, mas diferentes número de massa. Ou seja, o número de prótons é o mesmo, mas o de nêutrons não.
Isóbaros
Essa comparação é feita em átomos que apresentam o mesmo número de massa. Sendo assim, apresentam números diferentes de prótons, elétrons e nêutrons, mas possuem a mesma massa atômica.
Isótonos
Nesse caso, os átomos apresentam o mesmo número de nêutrons, variando o número de prótons, elétrons e de massa.
Isoeletrônicos
São átomos que em seu estado natural ou iônico que apresentam a mesma carga elétrica, ou seja, possuem o mesmo número de elétrons.








