O que é chuva ácida?
A chuva ácida é um fenômeno caracterizado pela precipitação da chuva com elevada acidez sendo consequência da poluição atmosférica. Naturalmente, todas as chuvas são consideradas ácidas. Isso porque mesmo em locais sem poluição há a presença de gás carbônico (CO2) capaz de reagir com a água gerando o ácido carbônico (H2CO3).
CO2 (g) + H2O (l) → H2CO3 (aq)
H2CO3 (aq) → H+ (aq) + HCO3– (aq)
HCO3– (aq) → H+ (aq) + CO32- (aq)
No entanto, o pH dessas chuvas fica em torno de 5,6 mas em pHs menores que 5,5 as chuvas se tornam nocivas e um problema ambiental.
O aumento da acidez da chuva pode ser provocado de modo natural ou pela atividade humana. De modo natural ocorre por meio da erupção de vulcões que acabam emitindo na atmosfera gases e partículas de enxofre. Além do vulcão, alguns processos biológicos como a respiração também provocam a liberação de gases que contribuem para a ocorrência do fenômeno. Já a principal atividade humana responsável pela diminuição do pH é a grande concentração de indústrias e veículos nos centros urbanos. Com a queima de combustíveis fósseis para geração de energia ou na utilização em veículos, há a liberação de uma grande quantidade de gases poluentes na atmosfera.
Em geral, esse aumento da acidez acaba sendo provocado devido ao aumento de óxidos de enxofre e nitrogênio na atmosfera. Esses óxidos e também o óxido de carbono são óxidos ácidos justamente por formarem ácidos em contato com a água. Em lugares populosos, com grande quantidade de veículos e de indústrias, as chuvas possuem pH de 4,5.
Como a chuva ácida é formada?
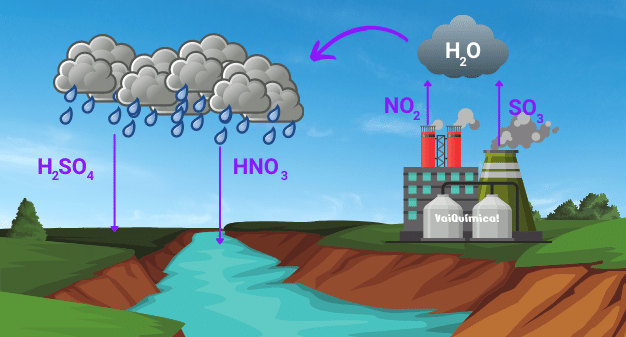
Para a formação da chuva ácida é necessário que os óxidos de nitrogênio e de enxofre, principalmente, estejam disponíveis no meio ambiente.
O óxido de nitrogênio é formado pela reação ocorrida entre nitrogênio gasoso (N2) e oxigênio (O2) que são gases encontrados naturalmente no ar. Para que o óxido seja formado precisa-se de muita energia e isso acontece com a elevação da temperatura por meio da queima de combustíveis nos motores dos carros ou então em fornos industriais. Com a temperatura elevada, os gases reagem entre si formando monóxido de nitrogênio.
O2 (g) + N2 (g) → 2 NO (g) (em altas temperaturas)
O monóxido de nitrogênio pode ser oxidado por outras moléculas de O2 e assim, forma o NO2. O dióxido de nitrogênio em contato com a água é responsável por formar dois ácidos: ácido nitroso e ácido nítrico.
NO2 (g) + H2O (l) → HNO2 (aq) + HNO3 (aq)
Embora o ácido nítrico seja um dos responsáveis pela chuva ácida, os principais compostos são os óxidos de enxofre (SO2 e SO3), uma vez que eles reagem com a água e formam o ácido sulfúrico que é um ácido mais forte.
O SO2 é produzido diretamente como subproduto da queima de combustíveis fósseis como por exemplo, a gasolina, o carvão e o diesel. Desse modo, o SO2 reage com a água formando o ácido sulfuroso:
SO2 (g) + H2O (l) → H2SO3 (aq)
H2SO3 (aq) → H+ (aq) + HSO3– (aq)
Além disso, o SO2 em contato com o O2 pode ser oxidado formando o trióxido de enxofre (SO3). O trióxido de enxofre em contato com a água forma o ácido sulfúrico.
SO2 (g) + ½ O2 (g) → SO3 (g)
SO3 (g) + H2O (l) → H2SO4 (aq)
H2SO4 (aq) → 2H+ (aq) + SO42- (aq)
Quais as principais consequências da chuva ácida?
As chuvas ácidas apresentam consequências principalmente ambientais. Com o aumento do número de indústrias, a poluição atmosférica também aumentou, provocando um aumento na emissão de gases poluentes que promovem a ocorrência da chuva ácida com muito mais frequência.
Dentre as principais consequências, temos:
- a chuva ácida torna o solo acidificado, o que faz com que alguns nutrientes fiquem menos disponíveis no ambiente;
- a contaminação do solo, pode provoca a contaminação de rios, lagos, além da contaminação de água subterrânea;
- essa contaminação da água promove uma perda da biodiversidade em ambiente aquático, uma vez que o aumento da acidez pode impedir o desenvolvimento de algumas espécies;
- em relação a vegetação, a diminuição do pH influencia no desenvolvimento e no crescimento das plantas, além de torná-las suscetíveis a pragas e doenças e de torná-las empobrecidas nutricionalmente;
- já levando em conta a saúde humana, o aumento da concentração de dióxido de enxofre pode promover o desenvolvimento de doenças respiratórias;
- a ocorrência de chuva ácida também é responsável por provocar estragos na “aparência” das cidades, uma vez que pode corroer e destruir prédios, estruturas metálicas de casas, edifícios e pontes, bem como a corrosão de monumentos que foram feitos de calcário, cimento, mármore, entre outros.







