Qual é o conceito de eletronegatividade?
A eletronegatividade é uma propriedade periódica que expressa a tendência que o átomo de certo elemento possui em atrair os elétrons para si em uma ligação química. Embora essa atração ocorra sobre todo o ambiente eletrônico que circunda o núcleo do átomo, é de particular interesse a atração efetiva que o núcleo exerce sobre os elétrons envolvidos na ligação.
O que determina o acontecimento dessa propriedade, então, é a capacidade do núcleo atômico possui para atrair esses elétrons.
Muitos estudiosos acreditam que a eletronegatividade é a propriedade periódica mais importante, uma vez que, induz o comportamento dos átomos durante a formação de moléculas.
Como identificar a eletronegatividade?
A melhor maneira de identificar a eletronegatividade de um átomo é analisando a Tabela Periódica.
Essa propriedade possui um comportamento similar à afinidade eletrônica na tabela.
Sendo assim, em uma família, a eletronegatividade aumenta à medida que o número atômico diminui, ou seja, de baixo para cima.
Já em um mesmo período, o aumento da eletronegatividade ocorre com o aumento do número atômico, desse modo, da esquerda para a direita.
Para auxiliar no entendimento dessa propriedade é importante mencionar a sua variação em relação ao raio atômico.
De modo geral, quanto menor for o raio atômico, maior será a eletronegatividade.

O que acontece é que a atração exercida sobre um elétron será maior quanto menor for o raio atômico.
Ao considerarmos os elementos pertencentes a um mesmo grupo,isso ocorre devido ao aumento do número de camadas eletrônicas. Assim, a distância entre o núcleo e os elétrons localizados na última camada eletrônica fica maior e a atração diminui. Esse elétron é o elétron necessário para a realização da ligação. Logo, os átomos mais acima possuem maior eletronegatividade que os localizados em baixo.
Em um mesmo período, todos os elementos apresentam um mesmo número de camadas eletrônicas, variando o número de elétrons pertencentes a cada elemento. Desse modo, a atração exercida pelo núcleo sobre os elétrons é maior e o raio atômico diminui, enquanto a capacidade de atrair elétrons aumenta.
Quais são os elementos mais eletronegativos?
Uma forma de identificar os elementos mais eletronegativos é por meio da escala de Linus Pauling.
Para a formação dessa escala, Pauling considerou uma molécula genérica A-B em que a energia de ligação seria determinada pela soma da média aritmética das energias de ligação das moléculas gasosas desses dois átomos.
Arbitrariamente, Pauling atribuiu a eletronegatividade do hidrogênio em 2,1 e por meio dele, conseguiu calcular e estimar a eletronegatividade dos outros elementos.
Desse modo, determinou uma escala utilizada até hoje para os elementos mais eletronegatividades, sendo ela mostrada a seguir:
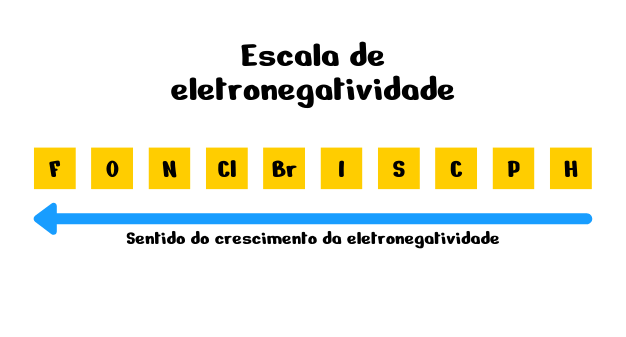
O valor para cada um desses elementos é:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 > 2,1
Para se recordar da ordem com maior facilidade algumas pessoas utilizam um macete, em que as iniciais de cada uma das palavras corresponde ao símbolo do elemento químico.
Fui Ontem No Clube, Briguei I Saí Correndo Para o Hospital
O que é eletropositividade?
A eletropositividade pode ser classificada como a propriedade periódica contrária a eletronegatividade.
Desse modo, corresponde à capacidade que os átomos possuem em ceder elétrons.
Essa propriedade também é chamada de caráter metálico, uma vez que, os metais apresentam maiores valores de eletropositividade.
Enquanto, na a eletronegatividade faz com que os átomos fiquem com carga elétrica negativa por atraírem os elétrons, a eletropositividade faz com que os átomos percam esses elétrons e fiquem com carga positiva.








