Polaridade das ligações
A ligação polar e apolar está relacionada com a polaridade das ligações. A polaridade é referente a capacidade que as ligações químicas possuem de atrair os elétrons para um dos átomos envolvidos.
Para determinar se uma ligação é polar ou apolar é necessário conhecer as propriedades dos elementos envolvidos na ligação, como a eletronegatividade. A eletronegatividade é a capacidade que o elemento possui de atrair os elétrons para si, sendo uma medida de polaridade. Logo, tem-se que:
- A ligação polar apresenta pólos que podem ser positivos ou negativos onde ocorre o acúmulo de carga elétrica. Logo, a diferença de eletronegatividade é diferente de zero;
- Já na ligação apolar, cargas elétricas estão distribuídas quase que uniformemente e a diferença de eletronegatividade é igual ou muito próxima de zero.
Sendo assim, sabe-se que a ligação sempre será polar para a ligação iônica, enquanto em ligações covalentes podem ocorrer as duas formas.
Ligações iônicas
A ligação iônica ocorre entre os átomos por meio de uma doação de elétrons. Neste tipo de ligação, a transferência de elétrons é definitiva e por isso, apresentam pólos carregados positivamente e negativamente.
Desse modo, ao ganhar elétrons, o átomo apresenta carga negativa e é chamado de ânion, enquanto o que perdeu elétrons possui carga positiva e é conhecido como cátion.
Devido a presença de átomos com carga oposta, sempre haverá uma diferença de eletronegatividade na ligação e é por isso, que toda ligação iônica é polar.

Ligações covalentes
A ligação covalente é caracterizada pelo compartilhamento dos pares de elétrons entre os átomos.
Por isso, dependendo do átomo que está envolvido na ligação, ela pode ser apolar ou polar devido a diferença de eletronegatividade entre os elementos.
Ligação covalente apolar
A ligação covalente apolar ocorre em uma ligação formada por átomos de um mesmo elemento. Ou seja, os átomos dividem igualmente os elétrons não ocorrendo a formação de pólos positivos ou negativos devido a mesma eletronegatividade dos átomos.
Ligação covalente polar
A ligação covalente polar ocorre quando dois átomos de elementos diferentes estão envolvidos em uma ligação. Sendo assim, os elétrons são compartilhados de maneira desigual, uma vez que, a eletronegatividade dos átomos é diferente.
Desse modo, o átomo mais eletronegativo apresentará os elétrons mais próximos a si, provocando uma distorção na nuvem eletrônica e adquirindo uma carga parcial negativa (δ–), enquanto o outro átomo tem carga parcial positiva (δ+).
Qual é a ligação mais forte: polar ou apolar?
Como mencionado anteriormente, a diferença de eletronegatividade entre os dois átomos é uma medida da polaridade da ligação.
Quanto maior essa diferença, mais polar essa ligação tende a ser e mais fortemente atraídos aos átomos eletronegativos os elétrons estão.
Em geral, tem-se que:
- Ligações covalentes apolares: diferença de eletronegatividade igual a zero devido ao compartilhamento de elétrons de maneira igual ou quase igual;
- Ligações covalentes polares: diferença de eletronegatividade até aproximadamente 1,7, uma vez que, o compartilhamento de elétrons é desigual;
- Ligação iônica: nesse caso, a diferença observada é acima de 1,7 já que há a transferência de elétrons entre os átomos.

Desse modo, pode-se dizer que a ligação iônica é a ligação mais forte, devido a grande diferença de eletronegatividade entre os átomos que provoca a transferência de elétrons e não o compartilhamento deles. Logo, ligações polares tendem a ser mais fortes que apolares.
Como saber qual substância é mais polar?
A polaridade das moléculas pode ser avaliada por dois fatores: eletronegatividade entre os átomos e a geometria molecular.
Para analisar somente a eletronegatividade entre os átomos, Linus Pauling criou uma escala de eletronegatividade dos elementos principais:
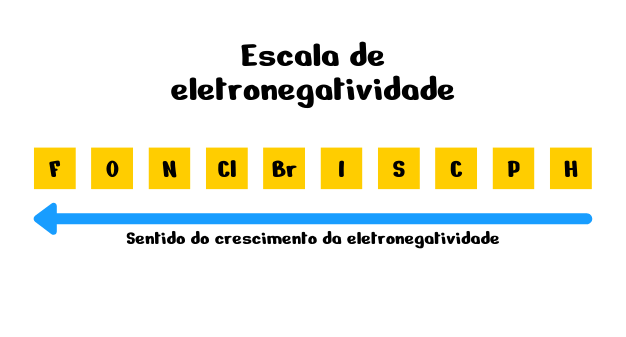
Logo, nessa escala o flúor é o elemento mais eletronegativo.
Ao considerar a geometria molecular, tem que quando o vetor do momento dipolar for zero, a molécula é apolar, mas se for diferente de zero é polar.
O cálculo do momento dipolar é realizado pela multiplicação entre a distância dos núcleos dos átomos e a carga em módulo e é indicado por setas em sentido ao elemento mais eletronegativo.








