O que são os processos endotérmicos e exotérmicos?
Os processos endotérmicos e exotérmicos são as reações químicas ou os processos físicos que envolvem a troca de energia em forma de calor. No nosso cotidiano, há inúmeros exemplos dessas reações que costumam ser estudadas pela Termoquímica. Um exemplo é a reação de combustão do carvão em que ocorre a liberação de energia em forma de calor. Já o processo de fotossíntese só ocorre porque acontece a absorção de energia do sol.
[rock-convert-pdf id=”2187″]
Qual a diferença de um processo endotérmico e exotérmico?
Processo endotérmico
O processo endotérmico é caracterizado pelas reações que envolvem absorção de calor. Nesses processos, o valor da entalpia dos produtos é maior do que a entalpia dos reagentes e desse modo, essa variação sempre será positiva (ΔH > 0).
Reagentes + calor → produtos
Graficamente, podem ser representados da seguinte maneira:

Um exemplo de processo endotérmico é a fotossíntese. Mas além da fotossíntese, são exemplos de reações endotérmicas:
- eletrólise da água que promove a produção de gás hidrogênio e oxigênio;
- produção de ferro por meio do aquecimento da hematita;
- de composição do calcário em CaO (cal virgem).
Em relação aos processos físicos, os processos de evaporação e fusão da água são endotérmicos. A evaporação de 1 mol de água precisa absorver cerca de 44 kJ para favorecer a sua mudança de estado do líquido para o vapor. Já a fusão da água acontece com uma quantidade de calor de 7,3 kJ, aproximadamente.
Processo exotérmico
O processo exotérmico envolve a liberação de calor. Nesse caso, como ocorre a liberação de energia, a entalpia final dos produtos é menor do que a dos reagentes impactando em uma variação de entalpia que será sempre negativa.
Reagentes → Produtos + calor
Desse modo, os processos exotérmicos podem ser representados graficamente assim:
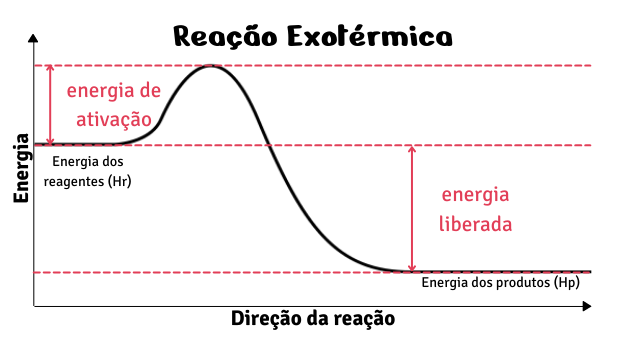
Assim como a reação de combustão do carvão, por exemplo, também são exemplos de processos exotérmicos:
- Solidificação da água que ocorre com a liberação de 7,3 kJ de energia;
- Condensação da água que chega a liberar cerca de 44 kJ durante a mudança do estado físico de gás para líquido;
- Queima de velas.









