Prova amarela
Um dos parâmetros de controle de qualidade de polpas de frutas destinadas ao consumo como bebida é a acidez total expressa em ácido cítrico, que corresponde à massa dessa substância em 100 gramas de polpa de fruta. O ácido cítrico é uma molécula orgânica que apresenta três hidrogênios ionizáveis (ácido triprótico) e massa molar 192 g mol−1. O quadro indica o valor mínimo desse parâmetro de qualidade para polpas comerciais de algumas frutas.
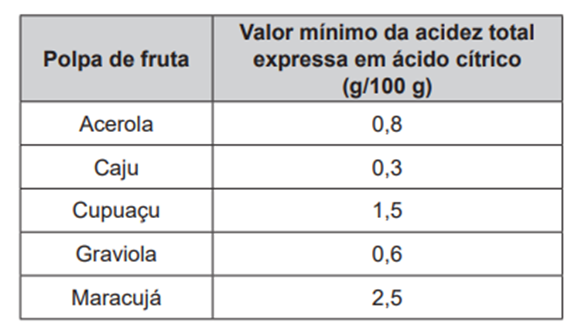
A acidez total expressa em ácido cítrico de uma amostra comercial de polpa de fruta foi determinada. No procedimento, adicionou-se água destilada a 2,2 g da amostra e, após a solubilização do ácido cítrico, o sólido remanescente foi filtrado. A solução obtida foi titulada com solução de hidróxido de sódio 0,01 mol L−1, em que se consumiram 24 mL da solução básica (titulante).
BRASIL. Ministério da Agricultura e do Abastecimento. Instrução normativa n. 1, de 7 de janeiro de 2000. Disponível em: www.agricultura.gov.br. Acesso em: 9 maio 2019 (adaptado).
Entre as listadas, a amostra analisada pode ser de qual polpa de fruta?
(a) Apenas caju.
(b) Apenas maracujá.
(c) Caju ou graviola.
(d) Acerola ou cupuaçu.
(e) Cupuaçu ou graviola.
Resolução
O primeiro passo para a resolução é determinar o número de moles de NaOH presente nos 24 mL consumidos na titulação.
1000 mL ————— 0,01 mol de NaOH
24 mL —————- X mol de NaOH
X = 24 x 10-5 mol de NaOH
O segundo passo é determinar quantos moles de ácido cítrico estão presentes em 2,2 g de polpa de frutas.
Mas antes, é necessário entender como ocorre a neutralização do ácido cítrico.
3 NaOH + ácido cítrico (que contém 3H+) → sal + água
Logo, para neutralizar um mol de ácido cítrico são necessários 3 moles de NaOH.
Sendo assim:
3 moles de NaOH ————— 1 mol de ácido cítrico
24 x 10-5 mol de NaOH —————— Y
Y = 8 x 10-5 mol de ácido cítrico
Sabendo disso, determina-se a massa do ácido:
1 mol de ácido cítrico —————- 192 g
8 x 10-5 mol de ácido cítrico ———- Z
Z = 0,01536 g
Para entender qual a acidez total:
2,2 g de polpa ———- 0,01536 g de ácido cítrico
100 g de polpa ———- W
W = 0,69 g (valor de acidez total em 100 g de polpa de fruta)
Resposta: C







