Nesse post você irá aprender:
- O que é a Química Inorgânica
- História da Química Inorgânica
- As Funções inorgânicas
- Tipos de reações inorgânicas
- A Importância da Química Inorgânica e suas aplicações
O que é a Química Inorgânica
A Química Inorgânica é a subdivisão da Química responsável por estudar as substâncias que não apresentam carbono na sua composição. No entanto, nem todos os compostos inorgânicos estão isentos da presença desse átomo. Isso acontece porque o carbono precisa estar formando cadeia para ser considerado orgânico e não inorgânico. Substâncias como o dióxido de carbono, o monóxido de carbono, o grafite e o ácido carbônico são alguns exemplos de compostos que possuem átomos de carbono, mas que são classificados como moléculas inorgânicas.
A história da Química Inorgânica
A distinção entre Química Orgânica e Inorgânica teve origem com a crença de que as moléculas existentes nos seres vivos só poderiam ser sintetizadas biologicamente e não em laboratório. Logo, estas substâncias foram denominadas de orgânicas, enquanto, as demais substâncias passaram a ser conhecidas como inorgânicas.
No entanto, no século XIX, evidências experimentais obtidas pelos cientistas da época inviabilizaram essa crendice. Desde então, há a divisão da Química em Orgânica e Inorgânica conforme a definição que se conhece atualmente.
Funções Inorgânicas
As substâncias inorgânicas podem ser classificadas em grupos de acordo com as suas características, composição e propriedades. Cada grupo é composto por moléculas que possuem semelhanças entre si, ou seja, que têm comportamentos parecidos em determinadas condições. Na Química Inorgânica, esses grupos são conhecidos como funções inorgânicas e são divididos em quatro grupos: ácido, base, sal e óxido.
Essa divisão foi proposta pelo químico Svante Arrhenius, em 1887, após a realização de experimentos observando a condutividade elétrica, em que se observou a formação de íons em solução aquosa.
Ácido
Segundo Arrhenius, o ácido é todo composto que, dissolvido em água, origina o H+ como único cátion, variando o ânion de ácido para ácido. Esse íon seria o responsável pelo gosto azedo.
Os ácidos podem ser divididos em dois grupos: os que não contêm oxigênio (não oxigenados) e os que contêm (oxigenados). Um exemplo de ácido não oxigenado é o ácido clorídrico (HCl), enquanto um ácido oxigenado é o ácido sulfúrico (H2SO4).
Na escala de pH, a acidez apresenta valores menores que 7.
Base
A base, de acordo com Arrhenius, é todo composto que, dissolvido em água, origina o OH– como único ânion em solução, variando o cátion de base para base. No caso das bases, esse íon é o responsável pela sensação de adstringência.
As bases podem ser classificadas de acordo com o número de hidroxilas em sua estrutura: monobases como o NaOH e o KOH, dibases como Ca(OH)2 e tribases como Fe(OH)3.
Na escala de pH, a basicidade apresenta valores maiores que 7.
Sais
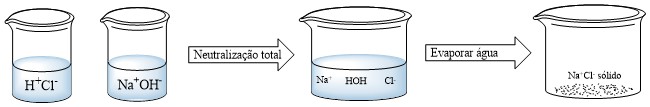
Quando um ácido e uma base, ambos em solução aquosa, são adicionados em um mesmo recipiente, ocorre a reação de neutralização, em que, os íons H+ e OH– interagem formando moléculas de água. Em solução, permanecem os íons restantes que interagem entre si formando um novo composto.
Logo, sal é o composto iônico formado pelo cátion proveniente de uma base e um ânion proveniente de um ácido. Em solução, os sais se dissociam e liberam íons diferentes de H+e OH–.
Óxidos
Os óxidos são todos os compostos formados pelo oxigênio como o elemento mais eletronegativo. Sendo assim, são os compostos formados por oxigênio e por outro elemento que não seja o flúor, uma vez que o flúor é o elemento com maior eletronegatividade.
Os óxidos são classificados em moleculares e iônicos. Os óxidos moleculares são os compostos em que o oxigênio está ligado com um outro elemento não metal ou com um semimetal, como por exemplo, o monóxido e o dióxido de carbono, CO e CO2, respectivamente. Já os óxidos iônicos apresentam o oxigênio ligado a um metal, como o óxido de cálcio, CaO.
Tipos de Reações Inorgânicas
O estudo realizado pela Química Inorgânica inclui também o conhecimento das propriedades das substâncias inorgânicas e das transformações (reações químicas) que podem ocorrer com elas.
Adição ou síntese
A reação de adição é a reação que apresenta dois ou mais reagentes, mas há a formação de um produto.
X + Y + … → P
Decomposição ou análise
É a reação que apresenta um reagente e dois ou mais produtos.
R → X + Y + …
Deslocamento ou simples troca
Nesse tipo de reação, há dois reagentes e dois produtos. Entre os reagentes, há uma substância inorgânica simples (um elemento só) e outra composta que reagem entre si e originam duas substâncias inorgânicas diferentes em que uma é uma substância simples e outra composta, assim como ocorre nos reagentes.
X + YZ → Y + XZ ou X + YZ → Z + YX
Dupla troca
A reação de dupla troca é caracterizada pela existência de dois reagentes e dois produtos em que todas as substâncias inorgânicas são compostas, ocorrendo uma troca de elementos entre as substâncias.
XY + ZW → ZY + XW
A importância da Química Inorgânica e suas aplicações
Diariamente, a sociedade está em contato com compostos inorgânicos sem se atentar à sua composição e a sua importância. A Química Inorgânica tem diversas aplicações, sendo encontrada em muitos aspectos do cotidiano.
- O mármore, por exemplo, é uma rocha que contém CaCO3, um sal inorgânico que também está presente nas cascas dos ovos;
- O gosto salgado da água do mar é devido à presença de vários sais inorgânicos dissolvidos como o NaCl e MgCl2;
- O gesso usado na ortopedia e o giz usado nas escolas contém outro sal inorgânico, o sulfato de cálcio, CaSO4;
- O NaOH que é conhecido como soda cáustica está presente nos produtos de limpeza;
- Enquanto os ácidos estão presentes em produtos como as baterias, o vinagre e alguns refrigerantes.







