O que é titulação e para que serve?
A titulação ácido-base é uma das técnicas utilizadas em laboratório para determinar a concentração de uma solução. Esse processo é feito utilizando-se de uma outra solução, mas essa com a concentração conhecida. A solução com concentração desconhecida é chamada de titulado, enquanto a solução com a concentração conhecida é o titulante.
Em geral, as titulações ocorrem com a utilização de uma substância ácida e outra básica. Desse modo, o que acontece durante o processo é uma reação de neutralização, com a formação de água e sal. Conhecer como a reação acontece e é equacionada é importante nesses casos para conseguir calcular de modo preciso a concentração.
No entanto, para visualizar a reação adiciona-se um indicador ácido-base ao titulado. Com a mudança de coloração observada, encontra-se o ponto de viragem ou o ponto de equivalência que indica o momento final da reação e assim, é possível parar a titulação e determinar a concentração da solução.
É importante ressaltar que embora o indicador ácido-base mostre o final da reação, nem sempre a solução final apresenta o pH neutro igual a 7. Por isso, saber como a reação em análise acontece é importante também para escolher adequadamente o indicador a ser utilizado.
O que é o indicador em uma solução ácido-base?
Os indicadores ácido-base são compostos inorgânicos que podem se comportar como ácidos fracos ou bases fracas. Eles são capazes de alterar a sua coloração gradualmente em uma faixa de pH chamada de zona de transição. Essa zona de transição corresponde aos limites de pH em que são perceptíveis as mudanças de cor.
Alguns exemplos de indicadores ácido-base são a fenolftaleína que apresenta zona de transição entre pH 8-10 mudando a coloração de incolor para rosa e azul de bromotimol com zona de transição entre pH 6,2-7,6 alterando a cor da solução de amarelo para azul. No entanto, existem muitos outros indicadores: vermelho de metila, alaranjado de metila, azul de timol, entre outros.
Como é feita a titulação?
A titulação apresenta uma aparelhagem própria para realizar o procedimento. Esse aparelho é composto por uma bureta em que se adiciona a solução de titulante e um recipiente (geralmente, o erlenmeyer) contendo o titulado com a adição de indicador ácido-base adequado. Em geral, o processo é realizado como se segue:
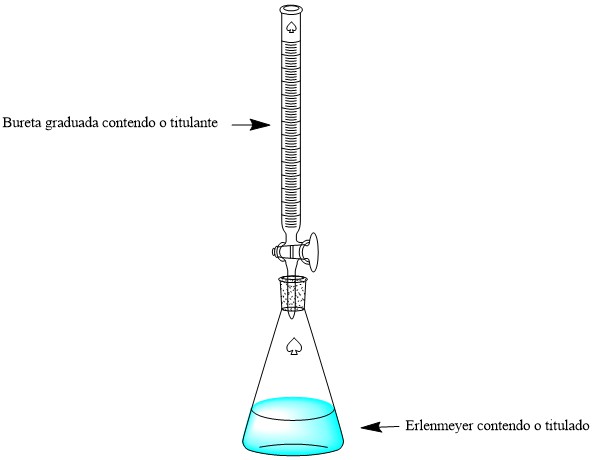
- Com o auxílio de uma pipeta adiciona-se um volume conhecido da solução que não se sabe a concentração ao erlenmeyer;
- O titulante é adicionado à bureta que é graduada e também apresenta o seu volume marcado e específico;
- Ao titulado no erlenmeyer adiciona-se algumas gotas do indicador;
- Em seguida, inicia-se a reação abrindo a torneira da bureta devagar para que gota a gota do titulante caia sobre o titulado. Esse processo precisa ser feito com calma, uma vez que uma gota é suficiente para se atingir o final da reação. Enquanto uma das mãos se posiciona na torneira, para ser fechada no momento adequado, a outra mão agita a solução no erlenmeyer com movimentos circulares para garantir a ocorrência da reação em toda a sua extensão;
- Ao final da reação, com a mudança da coloração, fecha-se a torneira e anota-se o volume de titulante gasto para realizar a completa neutralização da solução-problema.

Mas como determinar a concentração?
Vamos analisar um exemplo de uma reação de neutralização entre HCl e o NaOH. A reação ocorre da seguinte maneira:
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O
Ou seja, a relação é de 1:1 considerando os reagentes utilizados.
Supondo que o titulado é a solução de HCl, podemos adicionar, por exemplo, 10 mL dele ao erlenmeyer da titulação, mas não sabemos a concentração dele. O titulante será uma solução de 0,1 mol L-1 de NaOH. Ao final da reação, foram gastos um volume de 50 mL de NaOH. Ou seja, as informações que possuímos são:
Vtitulado=HCl = 10 mL = 0,01 L
Vtitulante=NaOH = 50 mL = 0,05 L
Concentração NaOH = 0,1 mol L-1
Sabendo que a relação é 1:1, temos que o número de mols são iguais, ou seja, nHCl=nNaOH.
Sendo a fórmula da concentração, temos:
[ ] = n/ V
[ ] . V = n
[ ]HCl . VHCl = [ ]NaOH . VNaOH
[ ]HCl . 0,01 L = 0,1 mol L-1 . 0,05 L
[ ]HCl = 0,5 mol L-1
Desse modo, a concentração desconhecida do titulado era de 0,5 mol L-1.







