O que é a distribuição eletrônica?
A distribuição eletrônica é a maneira em que os elétrons estão distribuídos em um determinado átomo.
A organização dos elétrons em níveis e subníveis de energia ocorreu após o modelo atômico de Rutherford-Bohr. Nesse modelo, o átomo apresenta nêutrons e prótons no núcleo enquanto os elétrons estão numa nuvem chamada de eletrosfera que apresenta diferentes camadas eletrônicas com valores distintos de energia.
Camadas eletrônicas
Atualmente, existem 7 camadas eletrônicas denominadas de K, L,M, N, O, P, Q que constituem os níveis 1, 2, 3, 4, 5, 6, 7 de energia, respectivamente. Cada camada pode conter um número máximo específico de elétrons e conforme se afaste do núcleo do átomo, maior a energia dos elétrons presentes nela.

| Nível de energia | Camada Eletrônica | Número Máximo de Elétrons |
| 1 | K | 2 |
| 2 | L | 8 |
| 3 | M | 18 |
| 4 | N | 32 |
| 5 | O | 32 |
| 6 | P | 18 |
| 7 | Q | 8 |
Subníveis de energia
Além disso, em cada camada ou nível de energia, os elétrons estão dispostos em subcamadas ou subníveis de energia. São identificados pelas letras: s, p, d, f e apresentam ordem crescente de energia, respectivamente. Assim como as camadas eletrônicas, cada subnível pode conter um número máximo de elétrons.
| Subnível | Número máximo de elétrons |
| s | 2 |
| p | 6 |
| d | 10 |
| f | 14 |
Com base nessas informações, sabe-se que cada camada é formada por diferentes subníveis de acordo com o seu número máximo de elétrons. A camada M, por exemplo, pode receber apenas 2 elétrons e por isso, só é formada pelo subnível s. Já a camada L, que pode receber 8 elétrons, é formada pelos subníveis s e p e assim por diante.
Por meio da distribuição eletrônica pode-se determinar: o número de elétrons no subnível mais energético e o número de elétrons na camada mais externa. O subnível mais energético é o último subnível a ser preenchido, enquanto a camada mais externa representa a camada de valência do átomo, uma vez que se localiza mais distante do núcleo.
Como fazer distribuição eletrônica?
Para facilitar, o químico norte americano Linus Carl Pauling (1901-1994) elaborou uma representação que permitiu a visualização da distribuição eletrônica e dos níveis crescentes de energia. Esse diagrama é conhecido como diagrama das diagonais ou diagrama de Pauling e as setas em sentido diagonal mostram a ordem em que ocorre o preenchimento em forma crescente de energia dos subníveis e camadas eletrônicas.
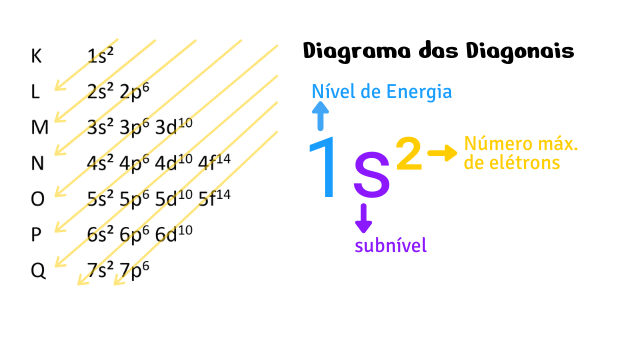
Para realizar a distribuição eletrônica dos elétrons dos átomos segue-se o diagrama de Pauling de acordo com a orientação das setas presentes nas diagonais. Cada subnível é preenchido com o número máximo de elétrons permitido nas camadas eletrônicas até se atingir o número de elétrons do átomo em questão.
Exercícios de distribuição eletrônica
Para compreender e visualizar melhor como realizar a distribuição dos elétrons, veja alguns exemplos. Como estamos analisando átomos em seu estado fundamental, o número de elétrons é igual ao número atômico dos elementos.
1. Carbono
Como o número atômico do carbono é 6, sua distribuição se dá:

Logo, a distribuição eletrônica do carbono é: 1s2 2s2 2p2.
2. Oxigênio
O oxigênio possui número atômico igual a 8. Sendo assim:
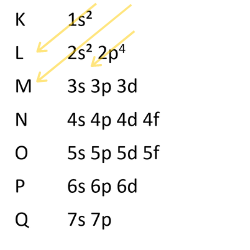
Por fim, a distribuição eletrônica do oxigênio é: 1s2 2s2 2p4.
3. Cloro
Para o cloro (Z=17):

Logo, a configuração eletrônica do cloro é: 1s2 2s2 2p6 3s2 3p5.
4. Cálcio
O número atômico do cálcio é 20, logo:

Assim, temos que a distribuição do cálcio é: 1s2 2s2 2p6 3s2 3p6 4s2.
5. Ferro
O ferro apresenta número atômico igual a 26. Atentando-se ao número máximo de elétrons permitido em cada subnível e camada de energia, tem-se:
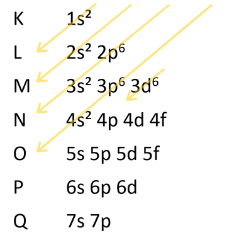
Desse modo, a distribuição eletrônica do ferro é: 1s2 2s2 2p6 3s2 3p6 4s2 3d6.








