O que é o processo de ebulição?
Ebulição é uma mudança de estado físico da matéria que marca a transformação da substância do estado líquido para o gasoso. Esse processo ocorre quando um líquido a uma dada pressão, recebe calor até se atingir uma dada temperatura.
Nesse momento, as moléculas da substância apresentam um aumento de energia e por isso, elas aumentam seu grau de vibração. Com o aumento da vibração das moléculas, a substância em estado líquido atinge uma quantidade de calor específica e passa para o gasoso.
Como ocorre a ebulição?
Quando uma substância encontra-se líquida, ela não apresenta uma forma definida e assim, tende a assumir a forma do recipiente que está. Além disso, as moléculas constituintes da matéria encontram-se coesas e relativamente próximas, interagindo umas com as outras.
Conforme as partículas recebem calor, promove-se o aumento da intensidade das vibrações das moléculas, o que faz com que elas se distanciam, tornando a interação entre as partículas quase inexistente. Nesse momento, as moléculas não apresentam forma definida e nem volume.
Outra maneira de visualizar é pelo aumento da pressão de vapor. Quando a matéria em estado líquido recebe energia, sua pressão de vapor tende a aumentar até que se torne igual a pressão de vapor do gás. Desse modo, ocorre a formação de bolhas que contém o vapor e ao serem estouradas liberam esse gás. Logo, para que as moléculas se tornem vapor é necessário que as forças de atração do líquido sejam superadas.
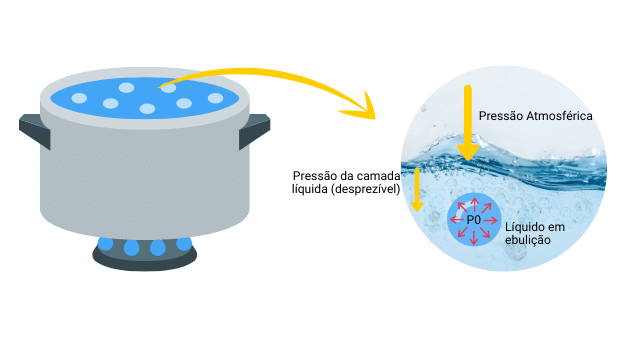
A quantidade de calor necessária para que ocorra a ebulição é específica para cada substância sendo chamada de temperatura de ebulição ou ponto de ebulição.
O que é o ponto de ebulição?
De acordo com a União Internacional de Química Pura e Aplicada (IUPAC), o ponto de ebulição é a temperatura em que a pressão de vapor do líquido se torna igual à pressão atmosférica. Essa temperatura depende da substância e da pressão aplicada.
Sendo assim, cada substância apresenta um ponto de ebulição, no entanto, uma mesma substância pode apresentar um ponto de ebulição diferente de acordo com a pressão exercida sobre a matéria. Ou seja, quanto menor a pressão, menor será a temperatura de ebulição e vice-versa.
Em relação às forças intermoleculares, sabe-se que quanto maior a interação e a força entre as moléculas, em geral, maior será o ponto de ebulição. Se essas interações forem fracas, essa temperatura será relativamente baixa.
Para substâncias puras e misturas azeotrópicas a temperatura é constante durante todo o processo de mudança do estado físico.
A nível do mar, a água possui Tebulição igual a 100oC, conforme a tabela a seguir.
| Substância | Ponto de ebulição, 1 atm (oC) |
| Água | 100 |
| Acetona | 56,5 |
| Etanol | 78,4 |
| Ferro | 2862 |
| Ácido Acético | 118 |
Calor latente
O calor latente é a quantidade de calor por unidade de massa necessária que a substância recebe para que possa entrar em ebulição. De modo mais específico, o calor latente de vaporização juntamente com a massa da matéria possibilita a quantificação do calor necessário para a ebulição da substância.
Para se calcular a quantidade de calor específica para a substância mudar de estado físico utiliza-se a fórmula matemática abaixo:
Qv = m . Lv
Nesta fórmula, tem-se que:
- Qv corresponde a quantidade de calor (cal);
- m é a massa da matéria (g);
- Lv é o calor latente de vaporização (cal/g).
Alguns valores de calor latente de vaporização são apresentados pela tabela a seguir.
| Substância | Calor latente de vaporização (cal/g) |
| Água | 539,6 |
| Etanol | 204 |
| Ferro | 1515 |
| Ouro | 377 |
| Metanol | 262,8 |








