Como fazer a nomenclatura dos ácidos?
Para realizar a nomenclatura dos ácidos, antes é necessário relembrar o conceito de ácidos. Segundo a Teoria de Arrhenius, o ácido é todo composto que, dissolvido em água, origina H+ como único cátion do sistema.
No entanto, para nomear esses compostos de função inorgânica é necessário identificar a qual grupo eles pertencem: aos hidrácidos (não oxigenados) ou aos oxiácidos (possuem oxigênio).
Hidrácidos
A nomenclatura dos hidrácidos apresenta uma regra geral como base.

Desse modo, para denominar esse tipo de ácido, basta escrever o nome do elemento, seguido do sufixo.
Qual a nomenclatura do HCl?
O HCl é um exemplo de hidrácido, ou seja, não apresenta átomos de oxigênio em sua estrutura. Sendo assim, para nomear esse ácido, identificamos o seu ânion. No caso do HCl, o ânion correspondente é o Cl– que é conhecido como íon cloreto.
Desse modo, o nome do HCl é ácido clorídrico.
Outros exemplos da nomenclatura de hidrácidos são mostrados a seguir:
| HF | Ácido fluorídrico |
| HBr | Ácido bromídrico |
| HI | Ácido iodídrico |
| H2S | Ácido sulfídrico |
| HCN | Ácido cianídrico |
É importante ressaltar que há também nomes comuns para esses ácidos que fogem da regra de nomenclatura adequada, mas que são utilizados usualmente e por costume, como por exemplo: cloreto de hidrogênio (HCl), fluoreto de hidrogênio (HF), brometo de hidrogênio (HBr), iodeto de hidrogênio (HI), sulfeto de hidrogênio (H2S) e cianeto de hidrogênio (HCN).
Oxiácidos
Para os oxiácidos, os ácidos mais comuns seguem a regra geral:
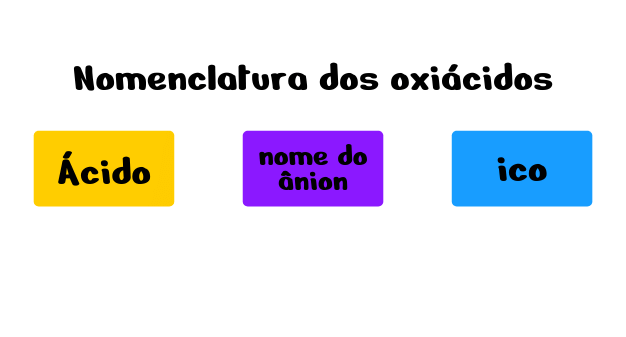
Como meio de facilitar a aprendizagem, considere os 4 ácidos apresentados a seguir:
| HNO3 | Ácido nítrico |
| HClO3 | Ácido clórico |
| H2SO4 | Ácido sulfúrico |
| H3PO4 | Ácido fosfórico |
Perceba que todos os nomes apresentados terminam com o sufixo -ico. Por meio deles, consegue-se a fórmula e a atribuição de nomes de outros ácidos.
Considerando o ácido clórico, por exemplo, por meio da adição ou da retirada de oxigênios na sua estrutura, há novos ácidos.
| HClO4 (ácido perclórico) | —- | —- | —- | per…ico | + O |
| HClO3 (ácido clórico) | H2SO4 (ácido sulfúrico) | HNO3 (ácido nítrico) | H3PO4 (ácido fosfórico) | …ico | ácido de referência |
| HClO2 (ácido cloroso) | H2SO3 (ácido sulfuroso) | HNO2 (ácido nitroso) | H3PO3 (ácido fosforoso) | …oso | – O |
| HClO (ácido hipocloroso) | —- | —- | H3PO2 (ácido hipofosforoso) | hipo…oso | – 2O |
Ou seja, a existência de um ácido padrão serve de base para nomear ácidos que apresentam um mesmo elemento central mas que variam a quantidade de oxigênio.
Carbono e boro formam os ácidos carbônico e bórico, cuja as fórmulas é útil conhecer:
- H2CO3 → ácido carbônico
- H3BO3 → ácido bórico
Como se sabe, elementos pertencentes a uma mesma família na tabela periódica possuem propriedades semelhantes. Desse modo, os ácidos formados com bromo (Br) e iodo (I) são semelhantes aos ácidos originados com cloro (Cl), uma vez que, todos pertencem ao grupo dos halogênios.







