O átomo de Bohr
O modelo atômico de Bohr ou átomo de Bohr foi proposto em 1913 e é a teoria responsável por relacionar a distribuição dos elétrons na eletrosfera em camadas de energia.
Sendo assim, no átomo de Bohr os elétrons estão presentes em um átomo distribuídos em diferentes camadas que se afastam do núcleo atômico, aumentando a sua energia. Além disso, Bohr também propôs que os elétrons podem absorver energia e saltar para um estado mais energético e ao retornarem ao seu estado fundamental liberam radiação.
Esse modelo baseou-se nas ideias de quantização de energia de Planck e Einstein e no modelo atômico anterior ao seu: o de Rutherford. É por isso que também é chamado de Rutherford-Bohr.
Como foi desenvolvido o modelo atômico de Bohr?
O modelo de Rutherford, proposto em 1911, apesar de esclarecer satisfatoriamente os resultados da experiência sobre a dispersão de partículas alfa, possuía algumas deficiências, como, por exemplo, não explicar os espectros atômicos e como os elétrons estavam distribuídos.
Diante dessa teoria, Bohr passou a estudar o comportamento do átomo de hidrogênio. A partir disso, ele observou que o gás era capaz de emitir luz com a passagem de corrente elétrica. Essa observação levaria o cientista a interpretar que os elétrons absorvem energia saltando para um nível mais energético e ao retornarem, emitem essa energia na forma de luz.


Desse modo, o átomo de Bohr possuía características associadas à mecânica clássica, uma vez, que núcleo e elétron no átomo de hidrogênio se atraíam de acordo com a lei de Coulomb e também, com a mecânica quântica, já que os elétrons se movem em órbitas fixas e só absorveriam e emitiriam energia ao passarem de uma órbita para a outra.
Quais os postulados da teoria atômica de Bohr?
Em seu modelo, Bohr incluiu uma série de postulados, sendo eles:
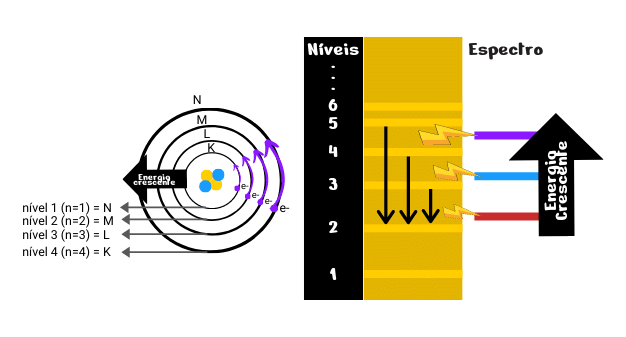
- Os elétrons, nos átomos, movimentam-se ao redor do núcleo em trajetórias circulares, chamadas de camadas ou níveis. Existem 7 níveis nomeados de K, L, M, N, O, P e Q ou níveis 1, 2, 3, 4, 5, 6 e 7 de energia;
- Cada um desses níveis tem um valor determinado de energia, ou seja, pode ser quantizada. (Por isso, são também denominados níveis de energia). Quanto mais longe do núcleo, maior é a energia dos elétrons localizados;
- Não é permitido a um elétron permanecer entre dois desses níveis;
- Um elétron pode passar de um nível para outro de maior energia, desde que absorva energia externa (ultravioleta, luz visível etc.). Quando isso acontece, dizemos que o elétron foi excitado e que ocorreu uma transição eletrônica. A situação em que os elétrons de um átomo estão com a menor energia possível é chamada estado fundamental desse átomo;
- A transição de retorno do elétron ao nível inicial ocorre com liberação de energia na forma de ondas eletromagnéticas, por exemplo, como luz visível ou ultravioleta.
Limitações da teoria atômica de Bohr
Esse modelo não consegue prever como ocorre a formação de moléculas por meio da ligação que ocorre entre os átomos. Além disso, como as observações foram realizadas com o átomo de hidrogênio, ele não consegue explicar o comportamento de outros átomos e nem a estrutura fina das suas linhas espectrais.
Aplicações do modelo atômico de Bohr
Cor no teste da chama
Ao aquecermos a ponta de um fio de metal com um bico de Bunsen contendo uma pequena amostra de cloreto de sódio (NaCl), por exemplo, observa-se uma coloração azul bem clara na chama seguida de uma intensa coloração amarela.
Ao repetir o procedimento, trocando-se o composto com elementos metálicos utilizados percebe-se que cada um deles produz uma cor característica ao ser submetido à chama. Esse procedimento é conhecido como teste da chama.
Segundo Bohr, quando os átomos são submetidos a uma chama, o calor excita os elétrons, o que faz com que eles passem para níveis de maior energia. Ao voltarem para o seu estado fundamental ou nível inicial, liberam energia na forma de luz, cuja cor é característica dos átomos de cada elemento.
Fogos de artifício
Os fogos de artifício são produzidos ao misturar pólvora à compostos de outros elementos químicos apropriados que originam a cor desejada.
Na hora da explosão da pólvora, há a excitação dos elétrons desses átomos. Ao retornarem aos níveis de menor energia, liberam a luz colorida: exatamente a cor que se observa no teste de chamas.
Luz laser
A definição de laser é “amplificação da luz por emissão estimulada de radiação”. Dentre eles, o mais simples é o laser de rubi.
O rubi é um sólido de fórmula Al2O3 que apresenta pequenas quantidades de íons Cr3+ que é a substância responsável pela cor vermelha. No laser, os elétrons dos íons Cr3+são excitados por meio de uma lâmpada tipo flash. Na volta, esses elétrons ficam presos num nível energético intermediário onde ficam por um curto período do tempo.
Com o uso de uma tecnologia, os elétrons são forçados a retornar de modo simultâneo para o estado fundamental num processo que é conhecido como emissão estimulada de radiação. Esse fato proporciona a obtenção de um feixe de luz de alta intensidade e de frequência bem definida que é aluz laser.
Bioluminescência: a luz dos vaga-lumes
Alguns seres vivos possuem um mecanismo em seu organismo: reações químicas responsáveis por usar a energia obtida dos alimentos para excitar elétrons de determinadas moléculas. Ao voltar para o seu estado fundamental, há a emissão de luz. Esse fenômeno é chamado de bioluminescência e está presente nos vaga-lumes.
Qual modelo atômico é usado atualmente?
Experimentos relacionados à difração de elétrons mostraram que os elétrons possuem comportamento dual: podem se comportar como onda eletromagnética ou como partícula.
Se um elétron irá se comportar como onda ou partícula dependerá apenas do tipo de experimento realizado e da técnica utilizada para acompanhá-lo. Erwin Schrödinger foi responsável por elaborar uma equação matemática que descreve o comportamento das ondas.
O modelo atômico surgido a partir da formulação proposta por Schrödinger era mais abrangente que os modelos atômicos anteriores (Dalton, Thomson, Rutherford e Bohr), explicando não apenas o comportamento do átomo de hidrogênio que é o átomo em que o modelo de Bohr é bem sucedido, mas aplicando-se também a sistemas mais complexos que apresentam maior número de prótons e elétrons.








