Os modelos atômicos foram estruturas propostas ao longo dos anos por diversos cientistas para compreender como o átomo era constituído.
Somente em 1808, o cientista John Dalton propôs pela primeira vez uma explicação para a propriedade da matéria. Dessa maneira, ele introduziu a primeira teoria atômica que considerava os átomos como partículas indivisíveis.
No entanto, filósofos gregos da antiguidade como Leucipo (500 a.C) e Demócrito (460 a.C) já haviam começado a pensar a respeito da composição da matéria em partículas muito pequenas e sem divisões. Mas como ainda não era possível comprovar essas ideias por meio de experimentos, essas discussões representavam apenas hipóteses, ficando em esquecimento até o surgimento do primeiro modelo atômico.
Ressalta-se que foram esses pensadores os responsáveis por nomear as partículas de átomos que é derivada do grego e que significa “que não se pode dividir”.
Até chegar no modelo atual, foram desenvolvidas diversos modelos de átomo como: modelo atômico de Dalton, Thomson, Rutherford e Bohr.
Modelo atômico de Dalton
Foi a primeira teoria que aplicou de forma satisfatória as ideias atomistas às reações químicas. Para Dalton, o átomo seria uma partícula esférica, maciça e indivisível e por isso, seria como uma “bola de bilhar”.

Esse modelo possui os seguintes enunciados:
- Os elementos químicos são formados por partículas pequenas, maciças e indivisíveis (átomos);
- Os átomos de um mesmo elemento químico são idênticos em todos os aspectos;
- Os átomos de diferentes elementos têm diferentes propriedades;
- Cada elemento é caracterizado pelo peso do seu átomo;
- A formação de uma substância composta se dá pela união entre os átomos dos elementos;
- Os átomos preservam sua identidade em todas as transformações químicas. Desse modo, nas reações químicas altera-se a combinação entre os átomos e não há a criação de novos átomos ou a alteração da sua estrutura.
Modelo atômico de Thomson
Por meio de experimentos realizados pelo cientista inglês Joseph John Thomson (1856-1940) com a utilização de um tubo de raios catódicos foi possível elaborar um novo modelo atômico.
O tubo de raios catódicos ou ampola de Crookes é um dispositivo que foi criado por Willian Crookes (1832-1919) e apresentava um tubo de vidro vedado contendo uma atmosfera rarefeita (gás com baixa pressão) em que se aplicava uma alta voltagem ao sistema. Essa tensão era aplicada devido à presença de um ânodo e de um cátodo no interior do tubo. Sendo assim, ao ser ligado observava-se os raios indo do cátodo (polo negativo) ao ânodo (polo positivo). Com isso, Thomson concluiu que os raios catódicos eram formados por partículas carregadas negativamente, ou seja, que a matéria era constituída por partículas negativas, os elétrons.
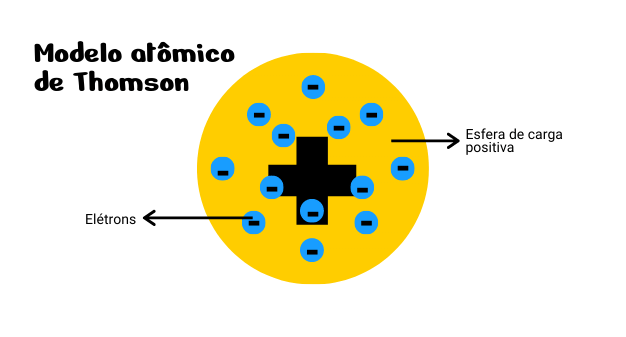
Essa descoberta implicou em um novo modelo atômico, uma vez que, o átomo não era indivisível como proposto por Dalton. Desse modo, o modelo atômico de Thomson foi o primeiro modelo a apresentar a ideia de divisibilidade do átomo em que o átomo era formado por uma esfera com carga elétrica positiva possuindo elétrons incrustrados na sua superfície. Assim, a carga elétrica seria neutra, uma vez que a carga elétrica positiva e negativa se compensariam.
Esse modelo é conhecido como “modelo pudim de passas” por lembrar um pudim/ bolo de passas.
Modelo atômico de Rutherford
O modelo atômico de Rutherford, 1911, foi o terceiro modelo atômico e é conhecido como modelo planetário. Nesse modelo, o átomo apresenta um núcleo denso e positivo que concentra a maior parte da massa de um átomo, enquanto os elétrons giram ao seu redor na eletrosfera. Esse modelo se tornou a base da teoria atômica e proporcionou um importante marco para o avanço da compreensão da matéria.
Para chegar nessa conclusão, Rutherford realizou um experimento constituído de um bloco de chumbo onde foi inserido no seu interior uma pequena amostra de polônio que é um elemento radioativo emissor de partículas alfa (α). A radiação emitida pelo polônio passava por um pequeno orifício presente no bloco de chumbo e ia em direção a uma fina lâmina de ouro que estava posicionada em frente ao bloco de chumbo. Já ao redor da folha de ouro, posicionou-se uma tela fluorescente.
Com o sistema montado, Rutherford “atirou” na folha de ouro partículas portadoras de carga elétrica positiva (partículas alfa). O resultado do experimento mostrou que a maioria das partículas alfa atravessava a folha em linha reta. No entanto, algumas poucas eram desviadas da sua trajetória, enquanto outras eram totalmente refletidas.

Desse modo, Rutherford propôs a existência de duas regiões no átomo: o núcleo (denso e positivo com os prótons) e a eletrosfera (região vazia onde os elétrons ficam girando ao redor do núcleo).
Modelo atômico de Rutherford-Bohr
O modelo atômico de Bohr foi proposto em 1913 e é a teoria responsável por relacionar a distribuição dos elétrons na eletrosfera em camadas de energia.
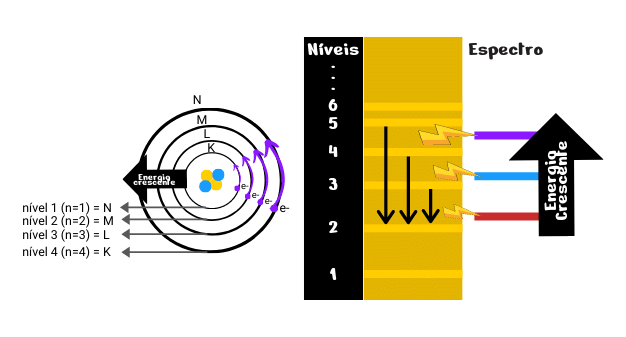
Desse modo, os elétrons presentes em um átomo estão distribuídos em sete diferentes camadas que se afastam do núcleo atômico, aumentando a sua energia, sendo elas: K, L, M, N, O, P e Q. Além disso, o modelo também apresentou que os elétrons podem absorver energia e saltar para um estado mais energético podendo retornar ao seu estado fundamental liberando radiação na forma de ondas eletromagnéticas.
Esse modelo baseou-se nas ideias de quantização de energia de Planck e Einstein e no modelo atômico anterior ao seu: o de Rutherford, sendo um aprimoramento desse modelo.
De maneira geral, os postulados de Bohr são:
- Os elétrons, nos átomos, movimentam-se ao redor do núcleo em trajetórias circulares, chamadas de camadas ou níveis. Existem 7 níveis nomeados de K, L, M, N, O, P e Q ou níveis 1, 2, 3, 4, 5, 6 e 7 de energia;
- Cada um desses níveis tem um valor determinado de energia, ou seja, pode ser quantizada em que mais longe do núcleo, maior é a energia dos elétrons localizados;
- Não é permitido a um elétron ficar entre dois desses níveis;
- Um elétron pode passar de um nível para outro de maior energia, desde que absorva energia externa (ultravioleta, luz visível etc.);
- A transição de retorno do elétron ao nível inicial ocorre com liberação de energia na forma de ondas eletromagnéticas, por exemplo, como luz visível ou ultravioleta.
Mapa Mental dos Modelos Atômicos









